IPOACUSIA IMPROVVISA
Novità editoriale
IPOACUSIA IMPROVVISA
Un percorso in un labirinto per una patologia del labirinto
Hanno collaborato:
G. Acquaviva, F. Casorati, S. Cisternino, N. De Luca, F. Mammarella, S. Millarelli, V. Rinaldi, L. Ruggeri.
Disegni originali di Lucia Balletti

Cos’è l’ipoacusia improvvisa?
L’ipoacusia è una delle principali cause di disabilità in tutto il mondo.
Insorge improvvisamente (come un fulmine a ciel sereno) ed ha un impatto devastante sulla qualità di vita; il quadro drammatico è peggiorato anche dal fatto che spesso si accompagna a violenti acufeni e vertigini talora imponenti.

Sebbene sia una condizione ben nota (descritta la prima volta nel 1944) che appassiona scienziati di tutto il mondo (negli anni sono stati pubblicati migliaia lavori su questo argomento), la fisiopatologia nella maggior parte dei casi rimane sconosciuta e conseguentemente la terapia posta in atto è ancora empirica.
Finora a livello internazionale non sono state accettate né una definizione né un protocollo di trattamento standard.
In primo luogo è importante tener presente che si tratta di un sintomo e non di un processo patologico indipendente. Resta ancora valida la brillante affermazione di Simmons: “È un sintomo alla ricerca di una diagnosi”.
Tra le molte definizioni utilizzate quella più usata recita: “una perdita uditiva di almeno 30 dB HL su tre frequenze contigue che si verifica in meno di 3 giorni”, ma ne esistono molte altre che considerano anche una minore intensità di perdita uditiva, un minor numero di frequenze interessate ed un tempo di esordio inferiore ai 3 gg.
Quasi sempre interessa un solo orecchio; la forma bilaterale è molto rara (2-3% dei casi).
L’ipoacusia improvvisa bilaterale ha spesso cause vascolari, metaboliche, immunologiche, infettive, neoplastiche, tossiche chimiche o infiammatorie, anche se l’occorrenza bilaterale non è patognomonica per queste cause.
Quale è la sua incidenza?
L’ipoacusia improvvisa costituisce più dell’1% di tutti i casi di perdita dell’udito.
È un riscontro relativamente comune nella pratica otologica e audiologica (1,5-1,7 per 100 nuovi pazienti che presentano a visita).
È stato calcolato che colpisce tra 2 e 20/100.000 abitanti all’anno.
La sua incidenza è probabilmente sottostimata principalmente per due motivi:
- spesso il paziente o il medico confondono il sintomo con una banale otite catarrale e la trattano di conseguenza;
- in molti casi (30-65%) si ha una guarigione spontanea che si verifica generalmente entro le prime due settimane, per cui il paziente non ricorre al medico specialista.
Indagini più recenti hanno ipotizzato un’incidenza molto più elevata: 160 ed anche 400 casi per 100.000 abitanti all’anno.
Si verifica con uguale incidenza negli uomini e nelle donne.
Ogni età può essere colpita ma l’incidenza massima è tra i 50 e 60 anni.
Prenota un appuntamento
- 375 665 6962
- 06-35504049
- (segreteria Lun-Merc-Ven ore 16-18)
- Via Barbiellini Amidei 28, ROMA
- c.pianura@hotmail.it
Da cosa dipende?
Sono state ipotizzate più di cento possibili cause capaci di determinare questo sintomo.
Autoimmune
Malattia dell’orecchio interno autoimmune, Malattia di Behçet, Sindrome di Cogan, Lupus eritematoso sistemico
Neurologico
Emicrania, Sclerosi multipla, Ischemia pontina multipla, Encefalite disseminata, sindrome da perdita CSF, (es. da puntura lombare)
Infettiva
“Virus neurotropi”: herpes zoster, herpes simplex, influenza, parainfluenza, mononucleosi, morbillo, parotite, citomegalovirus, Coxsackie, HIV, FSME, meningite batterica, HIV, febbre di Lassa, malattia di Lyme, parotite, micoplasma, sifilide, toxoplasmosi, Borrelliosi, febbre delle Montagne Rocciose
Otologica
Perdita dell’udito fluttuante Malattia di Ménière, Otosclerosi, Acquedotto vestibolare ingrandito, Barotrauma e trauma cranico
Neoplastica
Neurinoma dell’VIII, meningiomi petrosi, metastasi dell’apice petroso, mieloma, meningite carcinomatosa, tumore del sacco endolinfatico
Tossica
Antibiotici: aminoglicosidici, agenti chemioterapici, antinfiammatori non steroidei (es. salicilati)
Vascolare
Bypass cardiovascolare, ictus cerebrovascolare, anemia falciforme, disturbi del ritmo cardiaco, valulopatie, crisi ipertensiva, ipotensione, infarto dell’AICA, coagulopatia, sindrome da iperviscosità
Traumatica
Commozione dell’orecchio interno, trauma iatrogeno/chirurgia, fistola perilinfatica, frattura ossea temporale
Metabolica
Diabete mellito, ipotiroidismo, tossiche (ad es. droghe, farmaci, veleni industriali), insufficienza renale che richiede dialisi
Funzionale
Disturbo di conversione, simulazione
Genetiche
Malattia mitocondriale, MELAS
Allo stato attuale, con i mezzi diagnostici a nostra disposizione la causa certa è difficilmente determinabile, si pensa che siano diversi elementi alla base di questo sintomo: compromissione vascolare, malattie immunologiche, rottura delle membrane cocleari, infezione virale, traumi, tumori otologici, tossicità, cause neurologiche e metaboliche.
1) Cause otologiche
a. Rottura delle membrane
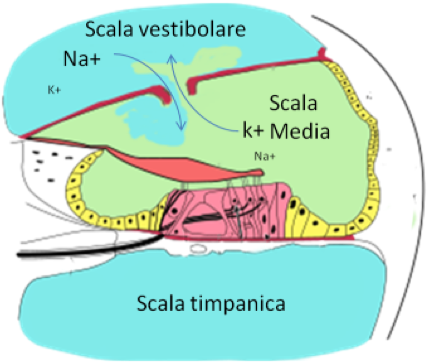
Una brusca variazione di pressione a livello dei compartimenti endo e perilinfatici, dovuti a sforzo fisico, manovra di Valsalva, soffiata il naso, starnuti trattenuti e da altre cause che determinano brusche variazioni di pressione può determinare la rottura delle membrane dell’orecchio interno (M. di Reissner, M. Basilare, M. tectoria o sacculo).
A seguito di tale rottura la perilinfa (ricca di sodio e povera di potassio) si riversa nel compartimento dell’endolinfa (ricca di potassio e povera di sodio); la composizione elettrolitica dell’endolinfa è fondamentale per il funzionamento delle cellule ciliate, ed una importante alterazione di tale composizione ne causa la sofferenza e la morte.
Quindi il compartimento diventa deficitario nella trasformazione dello stimolo acustico e nella trasmissione degli impulsi elettrici all’VIII nervo cranico, con conseguente ipoacusia.
b. Fistola perilinfatica (FPL)
La FPL è un’apertura anomala tra l’interno, l’orecchio e la superficie esterna dell’orecchio medio, con possibile fuoriuscita di perilinfa.
La PLF può essere secondaria ad alcuni fattori:
- barotrauma all’orecchio, sia esso esplosivo che implosivo;
- frattura;
- esplosione;
- trauma dell’orecchio medio;
- chirurgia dell’orecchio (es. stapedectomia – la fistola può prodursi anche dopo alcuni anni dall’intervento).
c. Sindrome dell’acquedotto vestibolare allargato
La sindrome dell’acquedotto vestibolare allargato è dovuta ad una piccola malformazione.
L’ipoacusia di solito è fluttuante e frequentemente recidivante e progressiva, e può essere facilmente confusa con una forma idiopatica di ipoacusia improvvisa.
L’ipoacusia può insorgere improvvisamente a seguito di un trauma cranico anche di lieve entità.
La diagnosi si fonda sulla TAC.
d. Malattia dell’orecchio idropico
L’idrope endolinfatica è una condizione clinica caratterizzata da un aumento della pressione dei liquidi a carico dell’orecchio interno. Tale aumento di pressione determina sofferenza delle cellule ciliate e conseguente ipoacusia che può essere fluttuante.
La perdita dell’udito interessa generalmente le basse frequenze.
Spesso percepita (e trattata) come perdita dell’udito improvvisa ricorrente.
La terapia in questo caso dovrebbe essere volta alla deplezione dei liquidi.
2) Cause infettive
Gli agenti causali infettivi potenzialmente coinvolti sono molti: virus, batteri, protozoi e miceti.
Il supporto alla teoria virale si basa su alcune osservazioni:
- quasi in un terzo dei casi l’ipoacusia improvvisa compare dopo un’infezione delle vie respiratorie superiori;
- pazienti con ipoacusia improvvisa idiopatica hanno spesso titoli virali più elevati in particolare per la famiglia dell’herpes;
- Alcuni esami istologici effettuati in pazienti che avevano sofferto di ipoacusia improvvisa hanno rivelato reperti simili a quelli trovati in caso di sordità da infezioni virali documentate (es. da rosolia).
L’infezione può sviluppare un danno diretto, attraverso una labirintite o una cocleite con distruzione del neuroepitelio o per un processo ischemico secondario ad un embolo settico o trombo.
Bisogna anche tener presente la possibilità di una riattivazione di infezioni latenti localizzate prevalentemente nel ganglio spirale (in particolare per i virus della famiglia Herpes) che è considerata una possibile spiegazione ritenuta a ragione “molto attraente”.
3) Cause vascolari
La coclea è estremamente sensibile all’apporto di ossigeno e, poiché la sua irrorazione è assicurata da un circolo di tipo terminale (non ha possibilità di compenso), un’ostruzione dell’afflusso arterioso determina rapidamente un calo di ossigenazione alle cellule che porta alla loro morte.
Alla base dell’ipoacusia improvvisa da causa vascolare possono sussistere vari meccanismi:
- Trombosi: formazione di trombi all’interno del vaso che ostacolano o impediscono la circolazione del sangue.
- Embolia: è l’occlusione del vaso da parte di piccoli coaguli provenienti da altre parti del corpo: possono essere di origine cardiaca, arteriosa o venosa. L’occlusione del vaso porta a sofferenza e morte delle cellule che ricevono sangue dal vaso occluso.
- Iperviscosità ematica: se il sangue è più denso può avere difficoltà a scorrere nei vasi sanguigni di piccolo calibro, determinando una diminuzione del flusso ematico soprattutto nei piccoli vasi. Il rallentamento facilita anche la formazione di trombi ed emboli.
- Spasmo vascolare: è una contrazione delle arterie dovuta a varie cause (malattie delle arterie, intossicazioni anche da farmaci, stress, ecc.) che determina un rallentamento della circolazione del sangue.
- Emorragia: l’emorragia labirintica può causare ipoacusia improvvisa con vertigini in pazienti in terapia anticoagulante o con una malattia ematologica; è riportata una prevalenza tra lo 0,3 e il 6,25% nei pazienti con SSNHL.
a. Infarto dell’arteria cerebellare anterio-inferiore (AICA)
L’Arteria uditiva interna fornisce l’orecchio interno ed è solitamente un ramo del A. cerebellare anterio-inferiore (AICA).
In caso di infarto dell’AICA la sintomatologia sarà complessa e variegata:
- sindrome di Horner (restringimento della rima palpebrale, enoftalmo, miosi, ipoidrosi del volto);
- diplopia;
- paralisi facciale;
- disturbi sensoriali del viso;
- disartria;
- atassia;
- nausea e vomito;
- riduzione controlaterale di dolore;
- sensazione di temperatura in diverse combinazioni; includere ipoacusia unilaterale e vestibolare (nistagmo, capogiri).
4) Cause Immunologiche
La patogenesi della perdita uditiva neurosensoriale e del deficit vestibolare immunomediato non è chiara ma verosimilmente si tratta di processi vasculitici (un’infiammazione dei vasi sanguigni) a carico dei vasi dell’orecchio interno e/o di autoanticorpi diretti contro determinanti componenti dell’orecchio interno.
La comparsa di una ipoacusia improvvisa è riportata in molti casi di malattie autoimmuni:
- sindrome da anticorpi antifosfolipidi: è stata segnalata la possibilità che si stabilisca un TIA (Attacco Ischemico Transitorio) cocleare a livello della stria vascolare in pazienti affetti da malattie autoimmuni ed in particolare dalla sindrome da antifosfolipidi;
- artrite reumatoide;
- lupus eritematoso sistemico;
- granulomatosi di Wegener;
- la sindrome di Sjögren primaria;
- colite ulcerosa;
- sindrome di Cogan: è una una vasculite autoimmune che colpisce la cornea e l’apparato oto-vestibolare, descritta per la prima volta da Cogan nel 1940; caratterizzata da improvvisa perdita dell’udito e da cheratite interstiziale.
L’ipoacusia improvvisa può essere il primo sintomo nel 50% dei casi. - Panarterite nodosa: è un’affezione sistemica caratterizzata da vasculite necrotizzante dei vasi di medio e piccolo calibro, specie renali.
La perdita uditiva è di raro riscontro in corso di malattia, benché descritta da numerosi autori.
La perdita dell’udito può essere l’unica manifestazione iniziale di questo disturbo. Gli studi istopatologici dell’osso temporale hanno mostrato arterite dell’arteria uditiva interna con diffuse alterazioni cocleari e vestibolari e nuova formazione ossea. - Malattia di Bechet: è una malattia rara di origine autoimmune caratterizzata da:
- ricorrenti afte orali e/o genitali;
- uveite;
- manifestazioni sistemiche che possono coinvolgere la pelle, le articolazioni, la vascolarizzazione, e sistema nervoso centrale;
- febbre;
- sordità bilaterale e ripetuti episodi di ipoacusia improvvisa.
5) Neurinoma
Il neurinoma del nervo acustico è un tumore benigno che interessa l’ottavo nervo cranico; la sua pericolosità è data dalla possibilità di aumento di volume che lo porta a invadere la fossa cranica e comprimere le strutture encefaliche.
Fortunatamente si è visto che circa la metà dei piccoli neurinomi raggiunto un certo limite non crescono. Ma questo rende indispensabile un accurato controllo nel tempo delle dimensioni.
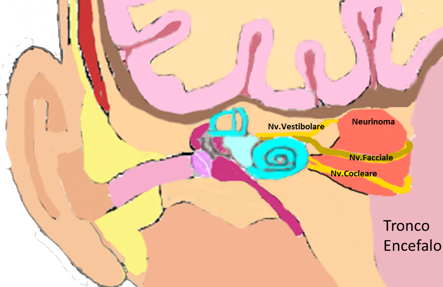
Tra i pazienti che presentano ipoacusia improvvisa, viene evidenziata la presenza di un neurinoma dell’VIII nel 2-3% dei casi.
Mentre il 20-30% dei pazienti affetti da neurinoma presenta una ipoacusia improvvisa tra i sintomi tipici, e il 10%-20%presenta tale sintomo come sintomo d’esordio.
La terapia del neurinoma, se tende a crescere, è essenzialmente chirurgica.
Bisogna considerare che l’asportazione del neurinoma, se di piccole dimensioni consente di conservare la funzione uditiva.
La Radiochirurgia mediante Gamma Knife è una tecnica di radiochirurgia stereotassica intracranica che permette di somministrare alte dosi di radiazioni con estrema precisione su un bersaglio all’interno del cranio localizzato profondamente che non può essere raggiunto mediante la chirurgia tradizionale, se non a costo di gravi lesioni residue.
6) Forme idiopatiche
Il termine “idiopatico” esprime la nostra incapacità di giungere ad una diagnosi: sono state pertanto proposte varie teorie come causa della ipoacusia.
L’80-90% dei casi di ipoacusia improvvisa, alla fine del percorso diagnostico, rientrano in questo gruppo.
Si pensa comunque che la causa debba essere ricercata tra ipotesi virale, vascolare, autoimmune e da rottura delle membrane dell’orecchio interno.
Fattori di rischio
I fattori di rischio più comunemente associati a SSNHL sembrano essere:
- Malattie cardiovascolari. Malattia cardiovascolare e ipertensione sono alcuni dei fattori di rischio segnalati associati a SSNHL, ma l’associazione definitiva non è stata dimostrata. È stato dimostrato in uno studio con ampio numero di pazienti che coloro che presentano MVP (PROLASSO DELLA MITRALE) hanno un rischio di 1,69 volte maggiore di sviluppare ipoacusia improvvisa rispetto ai pazienti senza MVP (Cheng 2018, Vazquez 2008);
- Fumo di sigaretta;
- Il Diabete è descritto come un fattore di rischio per SSNHL;
- Lo stress eccessivo;
- Dati meteorologici. Nell’area di Busan, sono stati rilevati rapporti statisticamente significativi tra il numero giornaliero di pazienti ricoverati in ospedale con SSNHL e dati meteorologici, incluso il livello di PM;
- Malattie infettive;
- Emicrania. Uno studio su 45.114 affetti da emicrania ha evidenziato che questi pazienti avevano una maggiore probabilità di sviluppare un’ipoacusia improvvisa (dati rilevati in tutti i sottogruppi di emicrania per età e sesso).
- Altre malattie. È stato rilevato un rischio maggiore di ipoacusia improvvisa nei pazienti affetti da Artrite Reumatoide rispetto al gruppo di controllo (0,8% [62/7619] rispetto a 0,6% [177 / 30,476] P = 0,021).
La relazione tra RA e SSNHL è stata osservata principalmente in pazienti di età ≥ 50 anni e uomini.
Diagnosi
Un problema comune è il ritardo nella diagnosi: in parte questo è dovuto al fatto che il paziente può sottovalutare il sintomo (soprattutto se lieve) o che il medico pone diagnosi di otite catarrale (in quanto il senso di “orecchio pieno” è un sintomo comune alle due forme cliniche ed in prima ipotesi si pensa alla causa più banale).
È importante cercare segni anamnestici e clinici che possano suggerire la presenza di altre malattie otologiche, cardio-vascolari, endocrinologiche, metaboliche, autoimmunitarie, neurologiche o di altro tipo.
L’identificazione di una causa precisa o quantomeno molto probabile dell’ipoacusia permette di non inserirla nel gruppo definito” idiopatico” e il quadro clinico verrà ulteriormente esaminato e trattato sulla base delle linee guida della malattia identificata.
Schema di valutazione iniziale per coloro che presentano una perdita uditiva improvvisa
Escludere altre patologie attraverso:
- Storia clinica: Il primo obiettivo è quello di escludere altre patologie.
Ricerca di eventuali fattori scatenanti o favorenti (picchi ipertensivi o ipotensione importante, ha preso freddo, ha avuto raffreddore o mal di gola o febbre, ha assunto sostanze o farmaci particolari, sforzi fisici, stress, discussioni, preoccupazioni, ecc.). - Se la storia suggerisce un problema vascolare centrale il caso va discusso urgentemente con il neurologo.
Esame fisico che comprende: otoscopia, test con diapason e esame neurologico.
Valutazione uditiva
- Audiometria a tono puro con prove sopraliminari, che permette di identificare la sede del anno uditivo (Coclea o VIII nervo).
- Audiometria vocale
- Impedenzometria con test obiettivi.
Questi esami vanno eseguiti prima possibile e sono importanti per definire il livello di ipoacusia, per tentare di stabilire la sede del danno uditivo (cocleare, nervo acustico o centrale).
Questi esami inizialmente vanno controllati ogni 2-3 giorni per monitorare la risposta alla terapia.
Esami di laboratorio
Vanno indagati diversi meccanismi corporei che possono essere svelati dagli esami di laboratorio:
- Variabili associate a infiammazione/infezione: proteina C reattiva > 10 mg/L, velocità di eritrosedimentazione >20 mm, conta dei leucociti e formula leucocitaria, conteggio dell’emoglobina (Hb) <120 g VES, proteina C reattiva.
- Variabili associate a infezione: dosaggio degli anticorpi IgG e IgM in pazienti con o senza infezione clinica in corso.
Non possono essere testati tutti i virus pertanto vengono testate le risposte per i virus descritti maggiormente come possibile causa della ipoacusia improvvisa: Herpes virus, Herpes Zoster, Citomegalovirus, EB Virus, Parotite, Borrelia.
In caso di positività di questi esami viene effettuata la PCR che conferma un’infezione in corso.
La PCR (Polymerase Chain Reaction) è una tecnica di biologia molecolare che consente la moltiplicazione (amplificazione) di piccoli frammenti di acidi nucleici virali, permettendo di stabilire la presenza di un determinato virus. - Variabili associate all’arteriosclerosi: colesterolo totale, HDL ed LDL, trigliceridi.
- Variabili associate al quadro immunitario. Nella diagnostica sierologica della SSHL della SI sono stati scoperti autoanticorpi contro antigeni specifici e non organo-specifici dell’orecchio interno. Anticorpi anticardiolipina, antifosfolipidi, anti-neutrofili anticorpi citoplasmatici (ANCA) e anticorpi antinucleari (ANA) –positivi.
Consulenze
Oculistica: importante per due motivi:
- Lo studio del fondo oculare ci da informazioni sulle condizioni del microcircolo del paziente.
- Esistono frequenti associazioni tra malattie dell’orecchio interno e malattie dell’occhio.
Neurologica: va richiesta quando si sospetta un coinvolgimento centrale nella patologia in studio.
Genetica: nel sospetto di una componente ereditaria.
Esami Strumentali
Esame doppler: Per lo studio della normale funzionalità dei grandi vasi che portano sangue all’orecchio (circolo carotido- vertebrale).
RMN: Per la ricerca o per escludere eventuali problematiche del SNC che potrebbero essere alla base della ipoacusia. Di estrema importanza per escludere la presenza di un neurinoma dell’VIII.
Le apparecchiature di ultima generazione possono anche fornire indicazioni sulla morfologia dell’orecchio interno.
Il contrasto è indispensabile.
Terapia
Il trattamento di SSNHL è controverso e la necessità trattare l’ipoacusia improvvisa è anche messa in dubbio da alcuni autori.
I meccanismi eziopatogenetici sono molteplici ma la maggior parte delle forme di trattamento pongono il loro fondamento nelle due principali teorie eziologiche (virale e vascolare).
Sebbene siano state introdotte molte opzioni terapeutiche per ISSNHL negli ultimi 80 anni, il peso della malattia rimane significativo.
Mancando un modello fisiopatologico chiaro, la terapia è spesso basata su considerazioni empiriche.
Le modalità di trattamento di successo suggerite sono moltissime a testimoniare l’incertezza sulla eziologia della ipoacusia improvvisa.
- corticosteroidi sistemici (desametasone, idrocortisone, betametasone, prednisone, cortisone, prednisolone, metilprednisolone);
- steroidi intratimpanici – terapie di combinazione (metilprednisolone intratimpanico, desametasone intratimpanico);
- agenti antinfiammatori;
- agenti antivirali.
- antitrombotici (pentossifillina, batroxobin, attivatore plasminogeno del tessuto ricombinante); vasodilatatori(prostaglandina E 1, naftidrofurile);
- vasodilatatori;
- aumento di ossigenazione dei tessuti (carbogeno);
- ossigenoterapia iperbarica;
- Plasma expander (Destrano 40, Destrano 40 + procaina cloridrato);
- diuretici.
- altre terapie [magnesio aspartato, magnesio solfato, fibrinogeno / aferesi LDL, mannitolo, nifedipina, fludiazepam, diazepam, ossigeno iperbarico, vitamina A, vitamina E, zinco, fitoterapia cinese, estratto di Ginkgo biloba, AM-111 (a c-giu N -Ligando chinasi terminale (JNK)), Ozonoterapia (autoemoterapia)
Tutte le energie della ricerca attualmente sono indirizzare a definire un protocollo diagnostico ideale in grado di definire la causa e conseguentemente instaurare un protocollo terapeutico differenziato.
Di fronte all’estrema variabilità delle possibili cause e all’impossibilità di una diagnosi precisa in tempi brevi, l’unica certezza deriva dalla necessità di un trattamento tempestivo e multimodale: quanto prima si inizia la terapia, tanto maggiori sono le possibilità di successo.
Ma al momento, non potendosi determinare con certezza la causa di questo sintomo viene attuato un trattamento polivalente che ha lo scopo di:
- migliorare l’afflusso di sangue alla coclea;
- ridurre l’infiammazione e la possibile pressione endolinfatica;
- controllare l’infezione virale.
Il regime di trattamento generalmente accettato è quello dei cortisonici in associazione con altri farmaci.
L’associazione più frequentemente impiegata è tra corticosteroidi (con gastroprotettori), “vasoattivi”, diuretici osmotici ed antivirali.
Carbogeno: il carbogeno è una combinazione di ossigeno (al 95%) e di anidride carbonica (5%). Viene utilizzato in pazienti in cui si sospetta un’eziologia vascolare per la loro perdita dell’udito in quanto è dimostrato che la CO2 è un potente vasodilatatore del sistema vascolare vestibolococleare, con conseguente aumento del flusso sanguigno.
Ossigenoterapia iperbarica: è un ambiente pressurizzato; al suo interno il paziente può respirare ossigeno puro o aria compressa ricca di ossigeno, a livelli di pressione superiori a quelli presenti nell’aria ambiente; questa modalità di trattamento aumenta i livelli di ossigeno disciolti nel sangue e la sua diffusione all’interno dei tessuti.
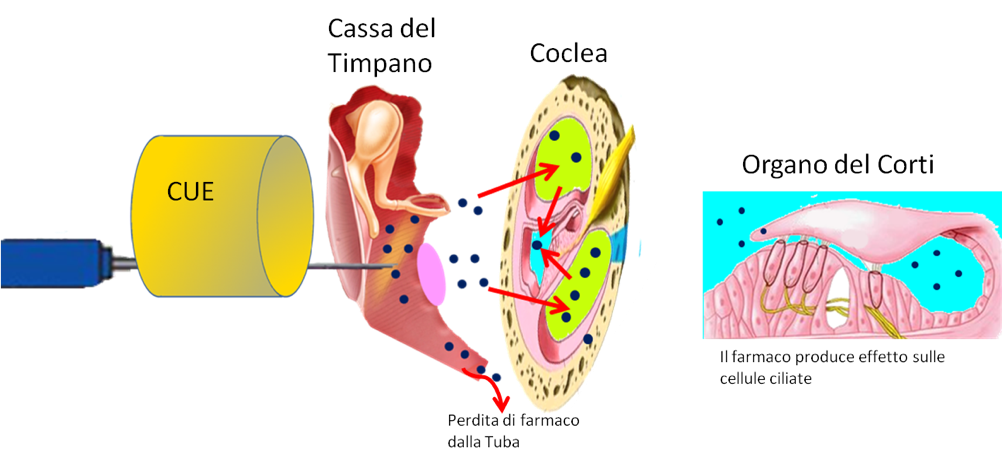
Infiltrazioni endotimpaniche di cortisone: è un’altra modalità di somministrazione del cortisone che saltando l’assorbimento sistemico, evita gli effetti collaterali secondari all’uso di alte dosi di cortisone.
Dopo un’anestesia locale per contatto, con un ago ultrasottile vengono introdotti 0.5 ml. di cortisone nella cassa del timpano.
Il paziente dovrà rimanere fermo in posizione supina con la testa inclinata di 30° per 20’.
In tal modo il cortisone viene assorbito nella coclea attraverso la finestra rotonda e farà il suo effetto farmacologico direttamente a livello locale.
È una procedura molto sicura, mininvasiva e può essere eseguita anche in uno studio medico.
La somministrazione intratimpanica produce concentrazioni molto più elevate di steroidi nell’orecchio interno rispetto alla somministrazione endovenosa o orale.
Vantaggi per gli steroidi IT
- può essere utilizzato quando gli steroidi sistemici sono controindicati o rifiutati;
- consente una maggiore concentrazione del farmaco nell’organo di Corti;
- può essere eseguito in ambito ambulatoriale;
- possibile utilizzo per il recupero dell’udito;
- ha un tasso di complicanze relativamente basso.
Viene utilizzata:
- come terapia esclusiva, in particolare nei pazienti cui non può essere somministrata la terapia cortisonica per via sistemica (es. diabetici, cardiopatie, ipertensione);
- in associazione con la terapia sistemica;
- come terapia di recupero, quando si constata che gli steroidi per via sistemica non producono un miglioramento uditivo.
Dovrebbe essere praticata entro le prime 2 settimane dall’esordio del sintomo.
In questi ultimi anni la nostra esperienza ci ha portato a proporre una terapia che è risultata estremamente valida tanto da raggiungere oltre il 70% di risoluzione con applicazioni ad alto dosaggio di steroidi per via locale (intratimpanica).
Valutazione del recupero
Siegel, 1976 99
Recupero totale: recupero > al 90% della perdita uditiva.
Recupero buono: recupero dal 50% al 90% della perdita uditiva.
Recupero scarso: recupero dal 10% al 50% della perdita uditiva
Recupero assente: recupero < al 10% della perdita uditiva.
Prognosi
La quota di pazienti che vanno incontro ad un recupero spontaneo valutata dal 32% al 65% dei pazienti entro 15 giorni dall’esordio. I pazienti trattati al di là della seconda settimana hanno una prognosi peggiore.
Alcuni autori hanno osservato che i pazienti trattati precocemente tendono ad un recupero più rapido e migliore rispetto a quelli trattati tardivamente.
Elementi sfavorevoli:
- Tempo trascorso tra la comparsa del sintomo e l’inizio della terapia > 14 gg.
- Perdita uditiva grave o profonda
- Presenza di Vertigine
Età: le possibilità di recupero sembrerebbero peggiori nei pazienti con un’età inferiore a 14 anni e superiore a 60.
Sesso: non esistono differenze.
La presenza di comorbidità (in particolare malattie cardiovascolare e diabete) aggravano la prognosi.
Insorgenza: nella giornata ha un significato prognostico peggiore rispetto alle forme che si presentano al risveglio.
Intervallo esordio – Inizio terapia
Il tempo intercorso tra l’esordio dell’ipoacusia improvvisa e l’inizio della terapia è stato identificato come il principale fattore prognostico per il recupero dell’udito.
Bilateralità
I pazienti con perdita uditiva bilaterale improvvisa hanno mostrato un’età inferiore, una prognosi peggiore e un più alto tasso di marcatori di risposta immunitaria positiva.
Vertigine
È riconosciuto in tutta la letteratura che la vertigine rappresenta un fattore prognostico negativo e per la maggior parte costituisce addirittura l’unico elemento prognostico significativo.
Acufene
Secondo alcuni autori la presenza di acufene ha un significato prognostico favorevole; altri ritengono scarso il significato prognostico di questo elemento; per altri ancora è peggiorativo.
Gravità della perdita iniziale
Maggiore è l’entità della perdita minori sono le possibilità di recupero.
Morfologia della curva audiometrica
Tran Ba Huy ha classificato le curve audiometriche in cinque tipi attribuendo un singolo significato prognostico a ciascuna di esse:
- ascendente (possibilità di recupero del 68%);
- piatta (48%);
- discendente (38%);
- particolarmente predittiva viene ritenuta la perdita della frequenza 8 KHz (130 Mattox – 89);
- a cupola (36%).
Assente o con residui uditivi (11%).
In letteratura i maggiori recuperi sono descritti per la perdita che coinvolgono prevalentemente le frequenze gravi.
Sede dell’ipoacusia
Le ipoacusie retrococleari hanno prognosi peggiore.
Condizione dell’orecchio controlaterale
Se l’orecchio controlaterale presenta ipoacusia le possibilità di recupero diminuiscono probabilmente perché è presente una debolezza pre-esistente del sistema uditivo.

